- Pacientes con condición
contenido de actualidad

Contenido de actualidad médica
Que le permitirán sumar conocimientos sobre el cuidado de la salud bucal de sus pacientes. ¡Explórelo ahora!
Estamos con ustedes para cuidar la salud bucal de sus pacientes
Lo hacemos mediante diferentes contenidos relacionados con el cuidado de la salud bucal de sus pacientes.
Seleccione su tema de interés

Descubra cómo proponer un tratamiento que mantenga el equilibrio entre el microbioma oral, mientras reduce la aparición de placa o caries dental1
-
Relación caries y alimentación
-
¿Qué causa la disbiosis en la caries dental?
La cavidad bucal tiene la segunda microbiota más grande y diversa después del intestino, alberga más de 700 especies de bacterias y tiene dos tipos de superficies en las que las bacterias pueden colonizar: los tejidos duros y blandos de los dientes, y la mucosa bucal.
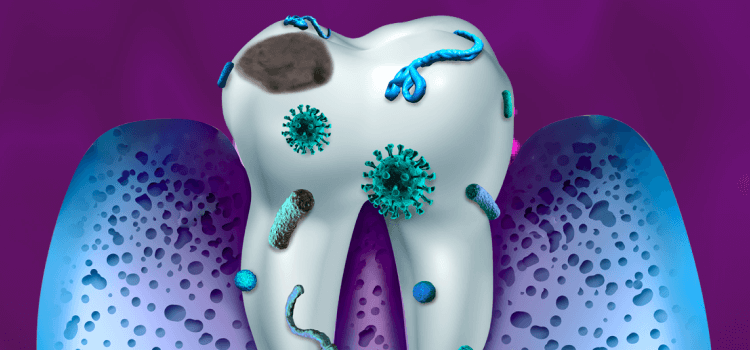
Estas superficies proporcionan un entorno rico en el que pueden prosperar los microorganismos formando la biopelícula, la cual se denomina placa dental cuando se desarrollan en los dientes.1, 2

Durante muchas décadas, la caries dental se describió como una enfermedad transmisible infecciosa y S. mutans fue descrito como el "archi-criminal".3
Se creía que estas bacterias eran agentes infecciosos y que los bebés adquirían este patógeno de sus madres solo después de la erupción de los dientes primarios4. En consecuencia, los tratamientos clínicos se enfocaron en prevenir o retrasar la transmisión de estos organismos, junto con intentos de suprimir o incluso eliminar el streptococo mutans en la cavidad bucal, con sustancias antibacterianas tópicas y vacunas. Sin embargo, este paradigma "un patógeno, una enfermedad" ahora ha sido reemplazado por un concepto holístico de una comunidad microbiana como la entidad de patogenicidad.5
Diversos estudios en personas de diferentes edades y con diferentes dietas de todo el mundo han demostrado diferencias sustanciales en la composición de las biopelículas que recubren las lesiones de caries.
Por lo tanto, el desarrollo de una lesión de caries se asocia con un cambio disbiotico en el equilibrio de la microbiota dental residente. El principal impulsor de tal cambio es el consumo frecuente de azúcares en la dieta.

La evidencia señala dos características principales que inciden en la aparición de caries:

La edad a la que se introduce el azúcar

La frecuencia del consumo de azúcar.6
La introducción temprana de sacarosa en la vida de un bebé promueve el establecimiento de una microbiota cariogénica y la colonización sucesiva de nuevas superficies dentales. Además, aumenta la preferencia de los niños por los dulces, lo que resulta en un mayor consumo de azúcar en alimentos y bebidas.7
Por otra parte la frecuencia del consumo de azúcares libres (añadidos por el productor o por el consumidor) e hidratos de carbono, especialmente en niños y adultos genera una respuesta dosis-dependiente; con una mayor ingesta aumenta el riesgo de caries por la producción repetida de ácidos y el mantenimiento de un pH muy bajo en la biopelícula dental; impidiendo la reposición fisiológica de minerales en el ciclo de desmineralización/remineralización.8

El inevitable bajo pH generado por el metabolismo de los azúcares promueve los microorganismos productores de ácido y amantes del ácido a expensas de las bacterias bucales beneficiosas que prefieren un pH cercano a la neutralidad.
El objetivo de la prevención primaria es por consiguiente preservar y mantener la simbiosis en la biopelícula bucal mientras que el objetivo de la prevención secundaria es restaurar un microbioma no saludable mediante la eliminación de estos impulsores de cambios adversos.


En este sentido los profesionales de la salud bucal deben alentar a los padres y adultos a realizar una correcta higiene bucal y no agregar azúcares libres a los alimentos y bebidas antes de los dos años de edad.
Según las recomendaciones de la OMS

Los azúcares libres deben constituir menos del 10% de la ingesta energética diaria para prevenir la caries dental y la obesidad e idealmente incluso menos del 5%, para minimizar el riesgo de caries dental a lo largo de la vida.

Preferiblemente masticar la fruta fresca entera para estimular el flujo salival que protege contra la desmineralización del esmalte dental en lugar del consumo de jugos y bebidas azucaradas que aumentan el riesgo de caries.

Limitar el consumo de hidratos de carbono fermentables que están compuestos por glucosa, sacarosa, fructosa, jarabe de maíz de alta fructosa y almidón cocido, y las fuentes de azúcares libres como confites, pasteles, galletas, cereales endulzados, postres dulces, sacarosa, miel, jarabes y conservas.9

El inicio temprano de un estilo de vida saludable que integre la prevención de la caries con el bienestar general es esencial, pues las pautas dietéticas para la prevención de la caries son idénticas a las de la prevención de la obesidad.
Vale la pena recalcar que la caries dental es una enfermedad no transmisible de etiología multifactorial que comparte factores de riesgo con otras enfermedades no transmisibles de alta prevalencia, como la obesidad, la diabetes y las enfermedades cardiovasculares; la ingesta de azúcar es uno de estos factores de riesgo.10

Teniendo en cuenta la evidencia científica disponible la evaluación individual del riesgo de caries (CRA) se considera de las mejores prácticas en la toma de decisiones de manejo de caries.11, 12
Actualmente existe un acuerdo para la evaluación de riesgos, con preferencia de un modelo multifactorial sobre una evaluación de factor único, ya que considera factores de protección, factores de riesgo sociales/médicos/conductuales y factores clínicos, poniendo la salud bucal dentro de la salud general.13

El más reciente modelo de evaluación de riesgo, Caries Care International (CCI) toma conceptos de Cariogram, ADA y CAMBRA, entre otros, para personas de todas las edades.
CCI considera factores protectores el uso de ≥ 1000 ppm de pasta dental fluorada dos veces al día, cuidado dental preventivo y fluoruro comunitario accesible. Este modelo además clasifica al paciente en dos categorías de riesgo:

Una versión simplificada que permite un manejo práctico del paciente donde se involucra el autocuidado en casa, el enfoque clínico y los intervalos de atención basados en el riesgo.14
Pero tal vez lo más relevante sea la comunicación equipo odontológico-paciente y el involucramiento en el cuidado de su salud bucal. Al tomar conciencia de su riesgo de enfermedad se aumenta la adherencia y la satisfacción de los pacientes con el cuidado dental.

El consejo de un profesional de la salud bucal es la razón #1 por la cual los pacientes adoptan nuevos hábitos de cuidado bucal. Como profesional usted puede lograr cambios positivos en las rutinas diarias de salud bucal que ayuden a prevenir la caries en sus pacientes.
LISTERINE® CUIDADO TOTAL ZERO
Es el enjuague bucal libre de alcohol y con sabor más suave. Su exclusiva fórmula con 4 aceites esenciales, flúor y cloruro de zinc, elimina hasta el 99.9% de las bacterias12, protegiendo y manteniendo las encías saludables.

Esta presentación sin alcohol es apta para niños a partir de los 6 años, edad en la que suelen tener más caries por el consumo de dulce, además de inculcarles una buena rutina de limpieza bucal desde pequeños.
Ofrece 6 beneficios en 1


Si este tema le interesó, descubra también nuestras recomendaciones.
-
Zaura E, Nicu EA, Krom BP, Keijser BJ. Acquiring and maintaining a normal oral microbiome: Current perspective. Front Cell Infect Microbiol 2014;4:85.
-
Dewhirst FE, Chen T, Izard J, Paster BJ, Tanner AC, Yu WH, et al. The human oral microbiome. J Bacteriol 2010;192:5002,Äê17.
-
SimoÃÅn-Soro A, Mira A. Solving the aetiology of dental caries. Trends Microbiol 2015; 23: 76-82.
-
Schwendicke F, Dorfer C E, Schlattmann P, Foster Page L, Thomson W M, Paris S. Socioeconomic inequality and caries: a systematic review and meta-analysis. J Dent Res 2015; 94: 10-18.
-
Colombo A P V, Tanner A C R. The Role of Bacterial Biofilms in Dental Caries and Periodontal and Peri-implant Diseases: A Historical Perspective. J Dent Res 2019; 98: 373-385.
-
Chaffee BW, Feldens CA, Rodrigues PH, Vítolo MR. Feeding practices in infancy associated with caries incidence in early childhood. Community Dent Oral Epidemiol. 2015 Aug;43(4):338-48. doi.org/10.1111/cdoe.12158.
-
Ventura AK, Worobey J. Early influences on the development of food preferences. Curr Biol. 2013 May;23(9):R401-8. doi.org/10.1016/j.cub.2013.02.037.
-
Peres MA, Sheiham A, Liu P, Demarco FF, Silva AE, Assunção MC, et al. Sugar consumption and changes in dental caries from childhood to adolescence. J Dent Res. 2016 Apr;95(4):388-94.
-
World Health Organisation. Oral Health: Achieving better oral health as part of the universal health coverage and noncommunicable disease agendas towards 2030. Geneva: World Health Organisation, 2020.
-
Fisberg M, Kovalskys I, Gómez G, et al. Total and added sugar intake: assessment in Eight Latin American countries. Nutrients. 2018 Mar;10(4):389.
-
Martignon S, Pitts NB, Goffin G, Mazevet M, Douglas GV, Newton JT, et al. CariesCare practice guide: consensus on evidence into practice. Br Dent J. 2019 Sep;227(5):353-62.
-
Mejàre I, Axelsson S, Dahlén G, Espelid I, Norlund A, Tranæus S, et al. Caries risk assessment: a systematic review. Acta Odontol Scand. 2014 Feb;72(2):81-91.
-
Senneby A, Mejàre I, Sahlin NE, Svensäter G, Rohlin M. Diagnostic accuracy of different caries risk assessment methods: a systematic review. J Dent. 2015 Dec;43(12):1385-93.
-
Cagetti MG, Bontà G, Cocco F, Lingstrom P, Strohmenger L, Campus G. Are standardized caries risk assessment models effective in assessing actual caries status and future caries increment? A systematic review. BMC Oral Health. 2018;18(1):123.
-
Elimina el 99.9% de las bacterias que causan la placa y el mal aliento. Estudios FCLGBP0028 y FCLGBP0048.
-
-
-
Sangrado de encías
-
El sangrado al sondaje es un parámetro clínico que precede a otros signos clínicos de inflamación gingival
La gingivitis es una lesión inflamatoria de los tejidos blandos que rodean el diente. Es una de las enfermedades bucales más comunes a nivel global1, 2. Resulta por una desregulación de la respuesta inmuno-inflamatoria inducida por un biofilm bucal disbiótico conocido como la placa3. Se manifiesta con varios signos clínicos, entre ellos el sangrado, el signo clínico más temprano, y se ve afectada por factores locales y sistémicos.2

Es evidente que esta lesión inflamatoria puede ser resuelta después del cuidado profesional adecuado, y mantenida por el cumplimiento, por parte del paciente, de los cuidados caseros.
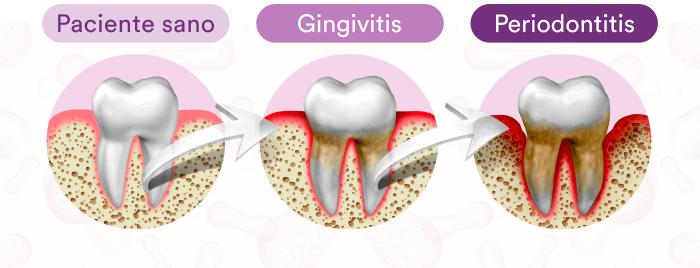
Si progresa sin tratamiento, la gingivitis puede llegar a ser una condición irreversible:

La periodontitis
La periodontitis se caracteriza por la destrucción de los tejidos blandos y el hueso alveolar de soporte de los dientes en pacientes susceptibles y puede llevar hasta la pérdida de los dientes4. De manera muy importante, la enfermedad periodontal ha sido asociada a enfermedades sistémicas como la diabetes y la enfermedad cardiovascular entre otras5. La relevancia de la salud periodontal en el bienestar general de la población justifica el conocimiento actualizado de los profesionales en todo lo relacionado con el inicio y el desarrollo de la gingivitis y la periodontitis para estar en capacidad de promover la salud periodontal, teniendo claro que esto va a contribuir en la calidad de vida de los pacientes.4
La gingivitis inducida por placa presenta diferentes patrones de signos y síntomas inflamatorios localizados en la encía libre y adherida. El sangrado al sondaje es un parámetro clínico que precede a otros signos clínicos de inflamación como el enrojecimiento y edema, tiene una correlación histológica con el infiltrado inflamatorio del tejido conectivo. Aun cuando los niveles de placa son mínimos, existe un infiltrado inflamatorio en el tejido como parte de la vigilancia inmunológica del huésped.6, 7
Sin embargo, la gingivitis inicia si el biofilm se acumula por días o semanas sin remoción, debido a la pérdida de la simbiosis entre el biofilm y la respuesta inmune del huésped, se produce una disbiosis incipiente. (Figure 1).
La respuesta inmune puede ser alterada por factores sistémicos como endocrinopatías, condiciones hematológicas, la dieta y algunos medicamentos8, 9

Las gingivitis asociadas a placa y/o a factores hormonales, medicamentos o enfermedades sistémicas presentan ciertas características esenciales que incluyen: signos clínicos y síntomas inflamatorios confinados a la encía libre e insertada, no se extienden más allá de la unión mucogingival. La inflamación es reversible con la remoción del biofilm. La cantidad de placa puede iniciar o exacerbar la severidad de la lesión (esto varía entre individuos). Los niveles de inserción se mantienen estables en el periodonto.

La gingivitis asociada a placa es una respuesta inflamatoria de los tejidos gingivales que resulta del acúmulo de biofilm a nivel o por debajo del margen gingival6. La gingivitis no causa directamente pérdida de dientes, sin embargo, es considerada un pre-requisito para el desarrollo de periodontitis, la pérdida de inserción progresiva alrededor de los dientes10. Entonces, el manejo de la gingivitis es una estrategia clave de prevención primaria para periodontitis y una estrategia de prevención secundaria para la periodontitis recurrente.6, 11, 12
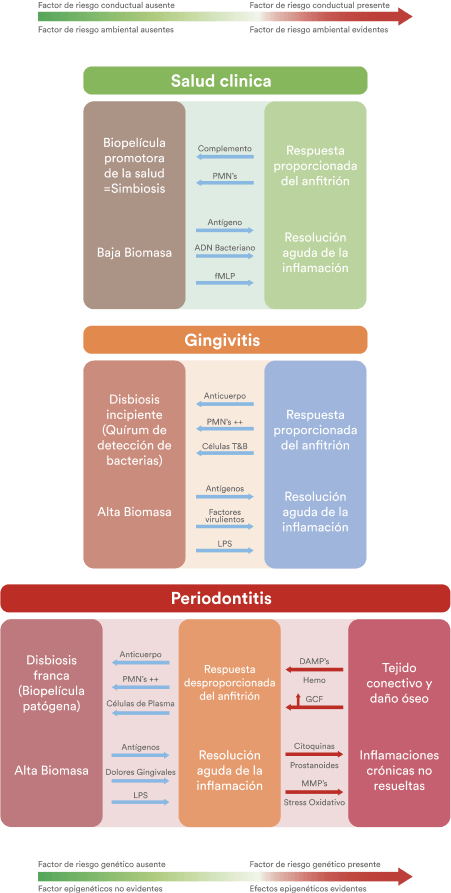
Figura. 1 Modelo contemporáneo de interacciones huesped-microorganismo en la patogénesis de la periodontitis, la respuesta del huesped crea una disbiosis incipiente (gingivitis). Si el biofilm no es removido resulta un disbiosis franca que perpetúa un proceso inflamatorio crónico destructivo. DAMPs, patrones moleculares asociados a daño; fMLP, N- formylmethionyl- leucyl- phenylalanina; GCF, fluido crevicular gingival; LPS, lipopolisacaridos; MMPs, metaloproteinaseas de la matriz; PMNs, polimorfonucleares neutrofilos (7). “Adaptado de Meyle et al., 2015.”

Existe evidencia epidemiológica que demuestra que la gingivitis inducida por placa presenta una alta prevalencia en todas las edades de la población con dientes y se considera la más común de las enfermedades periodontales.13
Por no ser clínicamente detectables los cambios iniciales de salud a gingivitis, se ha debatido la definición del umbral clínico entre la inflamación fisiológica y la patológica. Sin embargo, al progresar, la gingivitis inducida por placa adquiere una forma más estable y los síntomas y signos clínicos se hacen obvios.
Inicia a nivel del margen gingival y puede comprometer toda la encía. El paciente puede notar los signos y síntomas que incluyen sangrado al cepillado, sangre en saliva, edema, eritema y halitosis.14

La intensidad de los signos clínicos varía entre individuos y entre sitios de una misma dentición y pueden estar influenciados por diversas condiciones sistémicas como cambios hormonales, fumar, desnutrición y factores bucales relacionados con la anatomía de los dientes y otros factores retentivos de placa como restauraciones con márgenes no adaptados o subgingivales, entre otros.15
El sangrado al sondaje posee relevancia clínica en el diagnóstico de los tejidos periodontales. Tiene además importancia en el pronóstico del deterioro periodontal al persistir durante múltiples observaciones en el tiempo, y en el monitoreo del resultado del tratamiento. Además de determinar el nivel de inserción para hacer el diagnóstico y definir si la afección del paciente es reversible (gingivitis) o irreversible (periodontitis), puede servir como un parámetro para informar y motivar al paciente.16, 17, 18
Teniendo en cuenta que el sangrado al sondaje asociado a otros signos clínicos puede indicar los sitios inflamados que podrían progresar a periodontitis, para prevenir la pérdida de inserción y la destrucción de los tejidos periodontales es necesario tratar la gingivitis mediante intervenciones terapéuticas profesionales y personales locales como:
el cepillado, el uso de hilo dental y enjuagues.19


Haciendo referencia a los enjuagues, buscando mejorar la salud periodontal,
Chapple y colaboradores en 2015 hacen referencia a la remoción de placa como factor de fundamental importancia en la prevención de las enfermedades periodontales20. Considera sin embargo, que el cepillado con una crema dental que contiene flúor puede no ser suficiente para prevenir la enfermedad periodontal en algunos pacientes.
De acuerdo con el artículo de la Federación Dental Internacional (FDI), sobre la prevención y el manejo de las enfermedades periodontales para la salud bucal y la salud general, publicado en 201821, esta deficiencia podría suplirse con el uso de hilo dental y cepillos interdentales, y hace referencia además a algunos enjuagues específicos que ofrecen un beneficio como terapia adjunta a la terapia mecánica en el manejo y la prevención de la gingivitis.
Existe evidencia en la actualidad que indica que no tratar las enfermedades periodontales puede tener efectos serios sobre la calidad de vida de los pacientes, por las asociaciones entre varias condiciones sistémicas y la enfermedad periodontal.
Es esencial que esta enfermedad de tan alta prevalencia a nivel global sea manejada de manera efectiva empleando todo el conocimiento adquirido. Los profesionales en salud bucal están en la obligación de tener el conocimiento actualizado y de comunicar lo suficiente al paciente sobre su condición de manera que entienda y esté en la capacidad de tomar decisiones informadas sobre salud bucal. Para esto se deben valer de la comunicación efectiva para apoyar a los pacientes en el desarrollo de las actividades preventivas en casa buscando cambios en el comportamiento mediante la educación en salud bucal.22

Es ampliamente conocido que el mantenimiento de la salud periodontal depende de manera crítica del comportamiento del paciente en términos de buenas prácticas de higiene bucal y en la búsqueda de tratamiento cuando existe enfermedad.
Siendo así, es competencia de los profesionales en salud bucal que trabajan con pacientes susceptibles a enfermedad periodontal, proveer conocimiento basado en la evidencia con respecto a las acciones que deben tomar los pacientes para mantener su salud bucal, en un marco de comunicación que maximiza la probabilidad que los pacientes sigan las recomendaciones.

El consejo de un profesional de la Salud Bucal es la razón #1 por la cual los pacientes adoptan nuevos hábitos de cuidado bucal. Eduque a sus pacientes sobre la importancia del uso del enjuague bucal ayudándolos a crear un cambio positivo en su rutina diaria.
LISTERINE® CUIDADO TOTAL ZERO
Es el enjuague bucal libre de alcohol y con sabor más suave. Su exclusiva fórmula con 4 aceites esenciales, flúor y cloruro de zinc, elimina hasta el 99.9% de las bacterias23, protegiendo y manteniendo las encías saludables.

Esta presentación sin alcohol es apta para niños a partir de los 6 años, edad en la que suelen tener más caries por el consumo de dulce, además de inculcarles una buena rutina de limpieza bucal desde pequeños.
Ofrece 6 beneficios en 1

CONSULTE A SU PROFESIONAL DE LA SALUD BUCAL. Recuerda usar enjuague bucal después del cepillado y uso de hilo dental. Lee las instrucciones de uso.

Si este tema le interesó, descubra también nuestras recomendaciones.
-
Chapple ILC, Mealey BL, Van Dyke TE, Bartold PM, Dommisch H, Eickholz P, Geisinger ML, Genco RJ, Glogauer M, Goldstein M, Griffin TJ, Holmstrup P, Johnson GK, Kapila Y, Lang NP, Meyle J, Murakami S, Plemons J, Romito GA, Shapira L, Tatakis DN, Teughels W, Trombelli L, Walter C, Wimmer G, Xenoudi P, Yoshie H. 2018. Periodontal health and gingival diseases and conditions on an intact and a reduced periodontium: consensus report of workgroup 1 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Clin Periodontol 45(Suppl 20):S68-S77.
-
American Academy of Periodontology. Parameter on plaque-induced gingivitis. J Periodontol. 2000; 71(5 Suppl): 851-852.
-
Williams RC. 1990. Periodontal disease. N Engl J Med 322:373-382.
-
Graves DT, Correa JD, Silva TA. 2019. The oral microbiota is modified by systemic diseases. J Dent Res 98:148-156.
-
Kilian M, Chapple IL, Hannig M, Marsh PD, Meuric V, Pedersen AM, Tonetti MS, Wade WG, Zaura E. 2016. The oral microbiome—an update for oral healthcare professionals. Br Dent J 221:657-666.
-
Löe H, Theilade E, Jensen SB. Experimental gingivitis in man. J Periodontol. 1965;36:177-187.
-
Meyle J, Chapple I. Molecular aspects of the pathogenesis of peri- odontitis. Periodontol 2000. 2015;69:7-17.
-
Kinane DF. Periodontitis modified by systemic factors. Ann Periodontol. 1999;4:54-64.
-
ZmoraN,BashiardesS,LevyM,ElinavE.Theroleoftheimmune system in metabolic health and disease. Cell Metab. 2017;25:506-521.
-
KinaneDF,AttströmR.Advances in the pathogenesis of periodontitis. JClinPeriodontol. 2005;32(Suppl. 6):130-131.
-
Mariotti A. Dental plaque-induced gingival diseases. Ann Periodontol. 1999;4:7-17.
-
Tonetti MS, Chapple ILC, Jepsen S, Sanz M. Primary and sec- ondary prevention of periodontal and peri-implant diseases. J Clin Periodontol. 2015;42(Suppl. 16):S1-S.
-
Dye BA. Global periodontal disease epidemiology. Periodontol 2000. 2012;58:10-25.
-
Quirynen M, Dadamio J, Van den Velde S, et al. Characteristics of 2000 patients who visited a halitosis clinic. J Clin Periodontol. 2009;36:970-975.
-
Trombelli L, Scapoli C, Orlandini E, Tosi M, Bottega S, Tatakis DN. Modulation of clinical expression of plaque-induced gingivi- tis. III. Response of “high responders” and “low responders” to therapy. J Clin Periodontol. 2004;31:253-259.
-
Joss A, Adler R, Lang NP. Bleeding on probing. A parameter for monitoring periodontal conditions in clinical practice. J Clin Periodontol,1994;21:402-408. 20.
-
Lang NP, Joss A, Tonetti MS. Monitoring disease during supportive periodontal treatment by bleeding on probing. Periodontol,2000,1996;12:44-48. 21.
-
Lang NP, Joss A, Orsanic T, Gusberti FA, Siegrist BE. Bleeding on probing. A predictor for the progression of periodiontal disease? J Clin Periodontol, 1986;13:590-596).
-
Boyle, P. Mouthwash Use and the Prevention of Plaque, Gingivitis and Caries, Oral Diseases (2014) 20 (Suppl. 1), 1-68 doi:10.1111/odi.12187).
-
Chapple ILC et al. Primary prevention of periodontitis: managing gingivitis. J Clin Periodontol 2015; 42 (Suppl. 16): S71-S76
-
White Paper on Prevention and Management of Periodontal Diseases for Oral Health and General Health. FDI World Dental Federation 2018.
-
Frankel RM, Sherman HB. The secret of the care of the patient is in knowing and applying the evidence about effective clinical communication. Oral Diseases 2015; 21: 919-926.
-
Elimina el 99.9% de las bacterias que causan la placa y el mal aliento. Estudios FCLGBP0028 y FCLGBP0048.
-
-
-
Gingivitis y perdida de dientes
-
Entendiendo el manejo de la gingivitis como una estrategia de prevención primaria para la periodontitis, aunque ésta no sea en sí misma una causa directa de pérdida de los dientes.1
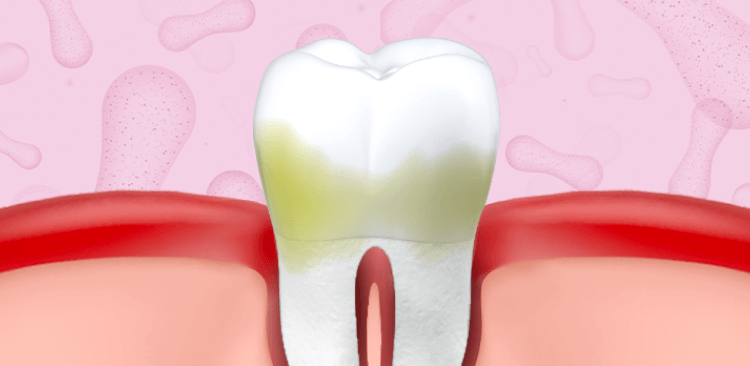
La periodontitis se caracteriza por la destrucción irreversible del tejido que resulta en pérdida de inserción progresiva y eventualmente lleva a la pérdida de los dientes2.
En su momento se encontró que la periodontitis severa era la sexta enfermedad más prevalente en el ser humano3 y se le ha considerado un problema de salud pública por su alta prevalencia, porque es incapacitante, porque afecta la calidad de vida y genera inequidad social.4, 5
Estimaciones más recientes la mencionan como la 11ª enfermedad más prevalente a nivel mundial6. Aunque la prevalencia global de la periodontitis es alta, algunos autores mencionan que en países de alto ingreso los datos relacionados con salud periodontal pueden haber mejorado en décadas recientes según lo derivado de estudios epidemiológicos nacionales y regionales.7, 8
Sin embargo, la prevalencia de formas más severas de periodontitis ha permanecido alta, afectando aproximadamente al 19% de la población en personas con más de 15 años9. Se reporta un aumento global significativo de la prevalencia (24%) y número de casos (540 millones más de afectados) de enfermedad periodontal severa entre 1990 y 20199. Una parte sustancial del aumento en el número de casos estaría relacionada con el aumento de la población mundial en general10. La prevalencia de periodontitis severa aumenta con la edad (ver Fig. 1). Con los cambios demográficos globales caracterizados por un mayor envejecimiento de la población y una mayor longevidad, se puede esperar una carga global aún mayor de enfermedad periodontal grave en el futuro9. Entender la naturaleza de la enfermedad es importante para la investigación y desarrollo de medidas de promoción, prevención y tratamiento más efectivas.

Fig.1 Tasas de prevalencia de cuatro enfermedades orales importantes a lo largo de la vida9
La gingivitis es una condición inflamatoria no específica inducida por biofilm11, que resulta del acúmulo de placa a nivel del margen gingival y por debajo de éste12. La gingivitis es la forma más común de enfermedad periodontal13. La información epidemiológica ha demostrado que la gingivitis inducida por placa prevalece en pacientes con dientes, de todas las edades.14-18
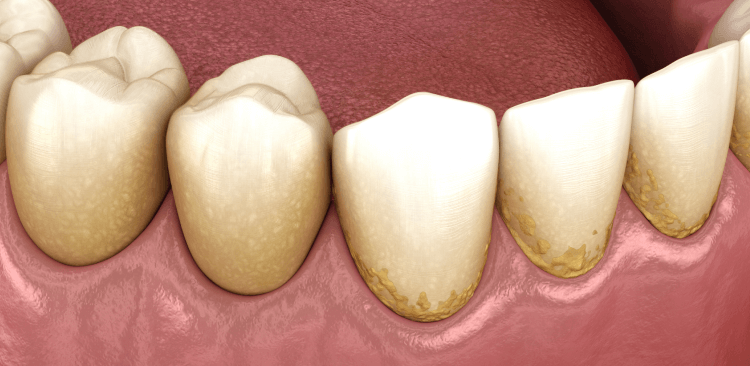
Los cambios iniciales de salud asociados con gingivitis inducida por placa pueden ser indetectables clínicamente. Esto ha hecho surgir debates con respecto al umbral clínico que define la inflamación fisiológica en contraposición a la inflamación con un carácter definidamente patológico.
Sin embargo, a medida que la gingivitis progresa a formas más establecidas de la enfermedad periodontal, aparecen los signos clínicos y los síntomas que pueden incluir sangrado durante el cepillado, presencia de sangre en la saliva, eritema y edema gingival y halitosis.19
La gingivitis no es causa directa de la pérdida de dientes, sin embargo su manejo es una estrategia de prevención primaria para la periodontitis1. De no ser tratada, la gingivitis podría progresar a periodontitis y esta condición sí es una razón frecuente para la pérdida de dientes en adultos.20, 21

Según Hirschfeld y Wasserman en 1978, el principal objetivo del tratamiento periodontal es la retención de la mayor cantidad de dientes posible, en salud, función y comodidad.22
Revisiones sistemáticas han evaluado la pérdida de dientes en pacientes que han sido tratados para enfermedad periodontal en clínicas universitarias y en prácticas privadas23, 24. En una publicación de 2010, se planteaba que la pérdida de dientes era comparable en los dos ambientes de atención, con rangos entre 0.1 and 3.3 dientes/paciente (promedio 1.4 dientes) en la práctica privada y entre 0.7 y 3.0 dientes/paciente (promedio 1.8 dientes) en universidades, aún después de 19 años de terapia de soporte periodontal.23
Más adelante en 2019 Helal y colaboradores24 reportaron una tasa de pérdida de dientes anual entre 0.05 y 0.23 dientes/paciente en estudios en prácticas privadas y entre 0.01 y 0.36 dientes/paciente en estudios realizados a nivel de universidades. En esta publicación se identificaron diversos factores asociados a la pérdida de dientes. Dentro de los factores propios del paciente se encontraron algunos no modificables como la edad, así como otros modificables como el hábito de fumar o mantenimiento irregular de citas. Además, se menciona como factor comorbilidades como diabetes. Por otro lado, los factores propios de los dientes mencionados fueron pérdida ósea inicial, bolsas residuales, movilidad y compromiso de furcas.24

La prevención de la recurrencia de la enfermedad periodontal que puede llevar a la pérdida de dientes es el principal propósito de la terapia periodontal25. Es bien sabido que la baja adherencia a la terapia de soporte periodontal lleva al deterioro del estado periodontal y al consecuente aumento de la pérdida de dientes en el tiempo.26

Ha sido mencionado extensamente en la literatura que la terapia periodontal de soporte o terapia de mantenimiento como tratamiento periodontal sistemático puede reducir significativamente el riesgo de pérdida de dientes en pacientes periodontales.27

Para prevenir la pérdida de inserción y la destrucción tisular periodontal es necesario acompañar las intervenciones terapéuticas profesionales de las intervenciones personales locales como el correcto cepillado, el uso de hilo dental y enjuagues bucales.28
Haciendo referencia a los enjuagues como medida para mejorar la salud periodontal, Chapple y colaboradores en 2015 mencionan la remoción de placa como factor de fundamental importancia en la prevención de las enfermedades periodontales29. Consideran, sin embargo, que el cepillado con una crema dental que contenga flúor puede no ser suficiente para prevenir la enfermedad periodontal en algunos pacientes, por ejemplo, aquellos que presentan condiciones como síndromes, tratamientos oncológicos, xerostomías, compromisos sistémicos, entre otros. De acuerdo con el Libro blanco de la Federación Dental Internacional (FDI) sobre la prevención y el manejo de las enfermedades periodontales para la salud bucal y la salud general, publicado en 201822, esta deficiencia podría suplirse con el uso de hilo dental y cepillos interdentales. Además hace referencia a algunos enjuagues específicos que ofrecen un beneficio como medida adjunta a la terapia mecánica en el manejo y la prevención de la gingivitis y por consiguiente de la periodontitis y la pérdida de dientes.
LISTERINE® es 1.8 veces más eficaz para prevenir la gingivitis bacteriana, producida por la acumulación de placa bacteriana (Comparado al uso de hilo, después de la profilaxis dental).30
Resultados superiores al adicionar LISTERINE® Cuidado Total a la rutina de limpieza mecánica diaria y como un aliado eficaz en las visitas a los odontólogos
Para el grupo control se consideró cepillado + solución control hidroalcohólica al 5%
REDUCCIÓN DE GINGIVITIS (MGI) EN LAS ÁREAS INTERPROXIMALES EN 12 SEMANAS VS CONTROL*

Enfoque integral del cuidado dental diario
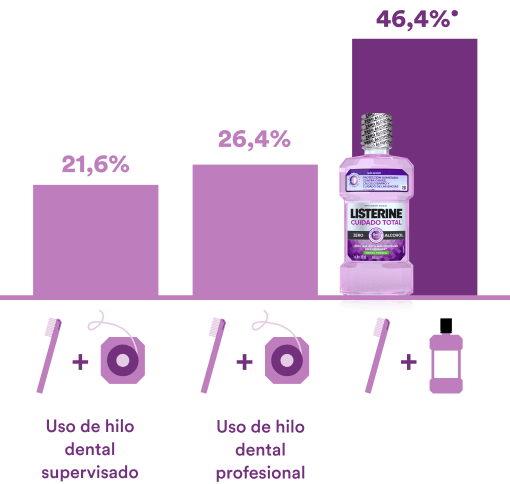
* Promedio de índice gingival modificado (MGI) comparado con control: cepillado + solución hidroalcohólica al 5%.
• §P < 0,001 en cada comparativa del producto investigacional vs cepillado + solución control hidroalcohólica al 5% (Control negativo)

Eduque a sus pacientes sobre la importancia del uso del enjuague bucal ayudándolos a crear un cambio positivo en su rutina diaria. Datos clínicos muestran que LISTERINE® es un eficiente aliado a las citas del dentista.
LISTERINE® CUIDADO TOTAL ZERO
Es el enjuague bucal libre de alcohol y con sabor más suave. Su exclusiva fórmula con 4 aceites esenciales, flúor y cloruro de zinc, elimina hasta el 99.9% de las bacterias**, protegiendo y manteniendo las encías saludables.

Esta presentación sin alcohol es apta para niños a partir de los 6 años***, edad en la que suelen tener más caries por el consumo de dulce, además de inculcarles una buena rutina de limpieza bucal desde pequeños.
Ofrece 6 beneficios en 1

CONSULTE A SU PROFESIONAL DE LA SALUD BUCAL. Recuerde usar enjuague bucal después del cepillado y uso de hilo dental. Lea las instrucciones de uso. LISTERINE® no tiene acción farmacológica o terapéutica para la periodontitis y gingivitis.
**Elimina hasta el 99.9% de las bacterias que causan la placa y el mal aliento. Estudios FCLGBP0028 y FCLGBP0048.
***Usando 10mL por 30 segundos.

Si este tema le interesó, descubra también nuestras recomendaciones.
-
Tonetti MS, Chapple ILC, Jepsen S, Sanz M. Primary and secondary prevention of periodontal and peri-implant diseases. J Clin Periodontol. 2015;42(Suppl. 16):S1-S4.
-
Tonetti MS, Eickholz P, Loos BG, et al. Principles in prevention of periodontal diseases. J Clin Periodontol. 2015;42:S5-S11.
-
Kassebaum NJ, Bernabe E, Dahiya M, Bhandari B, Murray CJL, Marcenes W. Global burden of severe periodontitis in 1990- 2010: A systematic review and meta-regression. J Dent Res. 2014;93:1045-1053.
-
BaehniP, TonettiMS, On be half of Group 1 of the European Work - shop on Periodontal Education. Conclusions and consensus state- ments on periodontal health, policy and education in Europe: A call for action - consensus view 1. Eur J Dent Educ. 2010;14:2-3.
-
Needleman I, McGrath C, Floyd P, Biddle A. Impact of oral health on the life quality of periodontal patients. J Clin Periodontol. 2004;31:454-457.
-
Nazir M, Al-Ansari A, Al-Khalifa K, et al. Global Prevalence of Periodontal Disease and Lack of Its Surveillance. The Scientific World Journal 2020; 2020: Article ID 2146160, 8 páginas. doi:10.1155/2020/2146160.
-
Holtfreter B, Schützhold S, Kocher T. Is periodontitis prevalence declining? A review of the current literature. Curr Oral Health Rep. 2014;1:251-261.
-
Norderyd O, Koch G, Papias A, et al. Oral health of individuals aged 3-80 years in Jonkoping, Sweden during 40 years (1973- 2013). II. Review of clinical and radiographic findings. Swed Dent J. 2015;39:69-86.
-
Global oral health status report: towards universal health coverage for oral health by 2030. Organización Mundial de la Salud (OMS), Ginebra; 2022. Licencia: CC BY-NC-SA 3.0 IGO.
-
Chen MX, Zhong YJ, Dong QQ, et al. Global, regional, and national burden of severe periodontitis, 1990-2019: An analysis of the Global Burden of Disease Study 2019. J Clin Periodontol. 2021; 48 (9): 1165-1188. doi:10.1111/jcpe.13506.
-
Löe H, Theilade E, Jensen SB. Experimental gingivitis in man. J Periodontol. 1965;36:177-187.
-
Mariotti A. Dental plaque-induced gingival diseases. Ann Periodontol. 1999;4:7-17. 6. Löe H, Theilade E, Jensen SB. Experimental gingivitis in man. J Periodontol. 1965;36:177-187.
-
White DA, Tsakos G, Pitts NB, et al. Adult Dental Health Survey 2009: Common oral health conditions and their impact on the population. Br Dent J. 2012;213:567-572.
-
Stamm JW. Epidemiology of gingivitis. J Clin Periodontol. 1986;13:360-370.
-
U.S. Public Health Service NIDR. Oral Health of United States Adults; National Findings. NIH Publ. No. 87-2868. Bethesda, MD: NIDR; 1987.
-
Bhat M. Periodontal health of 14-17-year-old US schoolchildren. J Public Health Dent. 1991;51:5-11.
-
Research, Science and Therapy Committee of the American Academy of Periodontology. Position paper: Epidemiology of periodontal diseases. J Periodontol 2005;76:1406-1419.
-
Dye BA. Global periodontal disease epidemiology. Periodontol 2000. 2012;58:10-25.
-
Page RC, Schroeder HE. Pathogenesis of inflammatory periodontal disease. Lab Invest. 1976; 33:235-249, Quirynen M, Dadamio J, Van den Velde S, et al. Characteristics of 2000 patients who visited a halitosis clinic. J Clin Periodontol. 2009; 36:970-975.
-
Oliver, R. C., & Brown, L. J. (1993). Periodontal diseases and tooth loss. Periodontology 2000, 2(1), 117-127.
-
Püllen, F., Folberth, R., Ruhmann, C., & Eickholz, P. (2013). Tooth extractions in general and due to periodontal reasons in three dental practices: A case-control study. Quintessence International (Berlin, Germany: 1985), 44(4), 327-338.
-
White Paper on Prevention and Management of Periodontal Diseases for Oral Health and General Health. FDI World Dental Federation 2018.
-
Chambrone, L., Chambrone, D., Lima, L. A., & Chambrone, L. A. (2010). Predictors of tooth loss during long-term periodontal maintenance: A systematic review of observational studies. Journal of Clinical Periodontology, 37(7), 675-684.
-
Helal, O., Göstemeyer, G., Krois, J., Fawzy El Sayed, K., Graetz, C., & Schwendicke, F. (2019). Predictors for tooth loss in periodontitis patients: Systematic review and meta-analysis. Journal of Clinical Periodontology, 46(7), 699-712.
-
Bertl et al., The impact of a“successfully treated stable periodontitispatient status”on patient-related outcome parametersduring long-term supportive periodontal careJ Clin Periodontol.2022;49:101-110.
-
Lee, C. T., Huang, H. Y., Sun, T. C., & Karimbux, N. (2015). Impact of patient compliance on tooth loss during supportive periodontal therapy: A systematic review and meta-analysis. Journal of Dental Research, 94(6), 777-786.
-
Hirschfeld, L., & Wasserman, B. (1978). A long-term survey of tooth loss in 600 treated periodontal patients. Journal of Periodontology,49(5),225-237.Becker et al., 1979.
-
Boyle, P. Mouthwash Use and the Prevention of Plaque, Gingivitis and Caries, Oral Diseases (2014) 20 (Suppl. 1), 1-68 doi:10.1111/odi.12187.
-
Chapple ILC et al. Primary prevention of periodontitis: managing gingivitis. J Clin Periodontol 2015; 42 (Suppl. 16): S71-S76.
-
Bosma ML, McGuire JA, Sunkara A, Sullivan P, Yoder A, Milleman J, Milleman K. Efficacy of Flossing and Mouthrinsing Regimens on Plaque and Gingivitis: A randomized clinical trial. J Dent Hyg. 2022 Jun; 96(3):8-20. Erratum in: J Dent Hyg. 2022 Oct; 96(5):5.
-
Promedio de MGI (Modified Gingival Index) en comparación con el cepillado + solución control hidroalcoholica al 5%.
-
-
-
Diabetes
-

Almost Done!
Please confirm the information below before signing in.
{* #socialRegistrationForm *} {* socialRegistration_firstName *} {* socialRegistration_lastName *} {* socialRegistration_emailAddress *} {* socialRegistration_displayName *} {* socialRegistration_gender *} {* socialRegistration_birthdate *} {* socialRegistration_address *} {* socialRegistration_unit *} {* socialRegistration_zipcode *} {* socialRegistration_addressType *} By submitting your information above, you agree that the information you provide will be governed by our site's Privacy Policy.